Una nueva serie de experimentos sobre el estudio del hielo a alta presión no permitió detectar transiciones de fase que deberían haber ocurrido si el agua fuera una mezcla de dos líquidos. Sobre la base de trabajos anteriores, los científicos querían estudiar el proceso de transformación del hielo ordinario en hielo amorfo de alta densidad, pero esta fase no se formó. Estos resultados refutan los datos sobre la estabilidad termodinámica del hielo amorfo y no confirman la hipótesis de dos fluidos de la estructura del agua, escriben los autores en el artículo publicado en Nature, según recogió Victor Román en N+1
Desde el punto de vista de la física, el agua es una sustancia muy complicada, se distingue por un diagrama de fase complejo y valores anómalos de capacidad y densidad de calor. Muchas de estas características aún no han recibido una explicación teórica completa. Uno de los problemas sin resolver es la estabilidad de algunas fases de agua sólida. En este momento, se conocen al menos 17 tipos diferentes de hielo cristalino y 3 tipos más de hielo amorfo, en los que la disposición de las moléculas no se caracteriza por un orden de largo alcance. De HDA a LDA
El punto de fusión de las formas más comunes en condiciones terrestres de agua congelada, el hielo Ih, disminuye al aumentar la presión. Como resultado, los científicos han obtenido hielo amorfo de alta densidad (HDA), que debería ser el estado vítreo del agua. El HDA también se puede mantener a una presión normal a bajas temperaturas, pero si se calienta en tales condiciones, se convierte en hielo amorfo de baja densidad (LDA), en lugar de la forma cristalina original.
Estudios adicionales de las interconversiones de HDA y LDA indicaron un cambio discontinuo en el volumen, y el proceso en sí es reversible y continúa sin ningún estado intermedio, lo que indica que pertenece a transiciones de fase del primer tipo. Estas circunstancias inspiraron a los teóricos a crear un modelo de agua como una mezcla de dos líquidos, ya que el límite entre los helados amorfos podría continuar en la región del agua subenfriada, parte del diagrama de fase donde el agua puede permanecer líquida, aunque a temperaturas bajo cero.Teóricamente, este límite de fase debe terminar en un punto llamado segundo punto crítico del agua, por analogía con el primer punto crítico, donde la diferencia entre el agua líquida y el vapor de agua desaparece. Dentro de este enfoque, cuando se excede la temperatura del segundo punto crítico, el agua debe ser una mezcla de dos líquidos con diferentes densidades, y dos tipos de hielo amorfo están asociados con ellos.
Mientras que la mayoría absoluta de los cristales bajo presión siguen siendo sustancias con un orden de largo alcance, el hielo, así como los minerales α-cuarzo y berlinita, han sido consideradas las únicas excepciones que se convierten en sustancias amorfas. Los dos últimos compuestos relativamente recientemente lograron convertirse en cristales al imponer una presión isotrópica.Resultado inesperado
Ahora, en un estudio dirigido por Chris Tulk, del Laboratorio Nacional de Oak Ridge en los Estados Unidos, por primera vez, se describen experimentos sobre la compresión del hielo por presión isotrópica, que fueron lo suficientemente lentos para observar una transición a un estado cristalino.
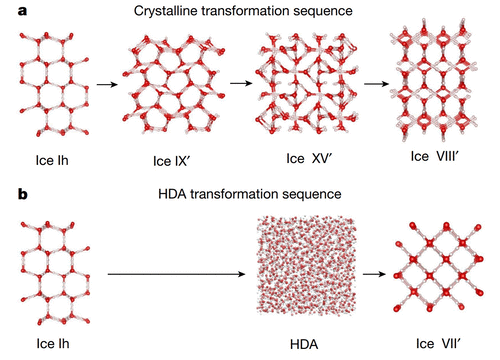
Durante el experimento, los científicos congelaron una gota de agua pesada de tres milímetros, que en lugar de hidrógeno ordinario contenía su isótopo con un neutrón adicional en el núcleo: deuterio. La muestra se enfrió a 100 grados Kelvin y luego, en unas pocas horas, la presión se elevó a 28 mil atmósferas. Entre cada aumento de presión, el hielo se estudió por difracción de neutrones, lo que permite establecer la estructura cristalina de una sustancia. Se utilizó agua pesada para mejorar la dispersión de neutrones y aumentar la precisión del método.
Los científicos esperaban ver un cambio en el ordenamiento molecular local al aumentar la temperatura y la presión a medida que el hielo pasaba al estado de líquido sobreenfriado y su posterior recristalización. Sin embargo, después de procesar los datos, se sorprendieron al encontrar que no había hielo amorfo, sino que la sustancia pasó por una serie de cuatro transformaciones entre diferentes fases cristalinas de densidad cada vez mayor: hielo Ih, hielo IX, hielo XV y el hielo VIII.Los autores creen que la razón del cambio es la presión lenta en el marco de los nuevos experimentos, mientras que los experimentos anteriores se llevaron a cabo mucho más rápido. Como resultado, la estructura del hielo tuvo tiempo de relajarse y alcanzar el equilibrio termodinámico, formando el hielo IX, mientras que en una transición rápida, debido a la cinética de la interacción de las moléculas, se obtiene un HDA, que no es una fase termodinámicamente más estable.
Al mismo tiempo, la transición directamente del hielo Ih al hielo XV no se produce debido a estructuras demasiado diferentes. «La relación entre la presión generada por el hielo amorfo y el agua ahora está en duda, y la segunda crítica puede no existir en absoluto», dice Talk. «Las conclusiones de este trabajo serán la base para el análisis del trabajo futuro sobre las fases amorfas del agua», añade.
Anteriormente, los científicos llegaron a la conclusión de que la similitud de los líquidos con el agua está determinada por su forma tetraédrica. También recientemente, por primera vez, fue posible obtener agua de baja densidad debido a la rápida descompresión del hielo.