La Agencia de Alimentos y Medicamentos de Estados Unidos (FDA por sus siglas en inglés) revisará de forma prioritaria, en seis meses, la solicitud de autorización de comercialización de su fármaco Yondelis para el tratamiento de todos los tipos de sarcoma de tejidos blandos.
El socio estratégico de PharmaMar para el desarrollo de Yondelis en EE.UU., Janssen Research & Development, presentó la solicitud ante la FDA el pasado 24 de noviembre de 2014, según ha informado este martes la filial de Zeltia. Yondelis fue designado medicamento huérfano para sarcoma de tejidos blandos por la Comisión Europea en 2001 y por la FDA en 2004, lo que se concede a fármacos indicados para el tratamiento de enfermedades raras. La FDA otorga la revisión prioritaria a aquellas terapias que pueden ofrecer un avance importante en cuanto a seguridad o eficacia del tratamiento, diagnóstico o prevención de enfermedades graves comparado con los tratamientos disponibles. La revisión prioritaria significa que FDA tomaría una decisión en 6 meses en vez de los 10 meses que conlleva la revisión estándar. Yondelis se comercializa en 77 países para el tratamiento de sarcoma de tejidos blandos avanzado y en 70 países para el cáncer de ovario recurrente sensible a platino en combinación con doxorrubicina. Archivado en: Empresas
CONTRIBUYE CON PERIODISTA DIGITAL
QUEREMOS SEGUIR SIENDO UN MEDIO DE COMUNICACIÓN LIBRE
Buscamos personas comprometidas que nos apoyen
COLABORA
Lo más leído
¿Tiene dos minutos? Vea a Javier Chicote desarmar en dos minutos a EH Bildu: “Me dan asco”
Carlos Alsina desenmascara a Pilar Alegría (PSOE) por su hipócrita andanada contra Bildu por no condenar los crímenes de ETA
Carlos Cuesta enmudece a Palomera y Casqueiro al relatar cómo fue señalado por ETA: “Éramos personas a eliminar o extirpar»
Baño de realidad a Bolaños en Valencia: cacerolada al ministro bajo el grito de “dimisión”
Hacienda devolverá a Alberto González, el novio de Ayuso, más de medio millón de euros
Arturo Pérez-Reverte, estupefacto ante la última cacicada de la Justicia controlada por el socialista Bolaños
El Gobierno de Sánchez dio dinero público a Begoña Gómez para un proyecto contra la despoblación
Un tibio García-Page vuelve a hacer el papelón de su vida arremetiendo contra Sánchez
Ana Vázquez (PP) acaba de un plumazo con la obsesiva fijación de un diputado de Más Madrid con Ayuso
El formidable troleo de Ayuso a un reportero de laSexta por hacer las veces de propagandista del PSOE
Juan del Val zurra al desinformado Jorge Javier Vázquez sobre los motivos del fichaje de David Broncano por TVE
Adanero revela a Rojo quién gobernará en el País Vasco y avisa de qué elecciones reventarán a Sánchez
Isabel Díaz Ayuso zarandea en directo al periodista trolero de ‘El Plural’: «¡Usted va a tener que disculparse!»
Un experto en terrorismo hiela la sangre al avanzar qué pasará tras el ataque de Irán a Israel
Ana Vázquez (PP) acaba de un plumazo con la obsesiva fijación de un diputado de Más Madrid con Ayuso
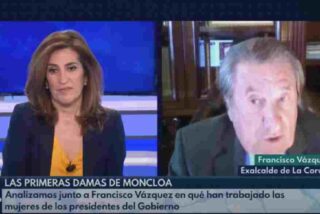
El histórico socialista Francisco Vázquez pone a temblar a Pedro Sánchez con una descarnada afirmación sobre Begoña Gómez
Carlos Alsina, estupefacto ante el ‘olvido’ del PSOE al presentar su lista de comparecientes para el ‘caso Koldo’
Esta es la cara que se le queda a Sánchez cuando le gritan que «por 7 votos tiene el culo roto»
El colosal sermón de Rafa Latorre sobre el fichaje de David Broncano por TVE retumba en La Moncloa
Alfonso Ussía desvela quién es la persona que tiene aterrorizado a todo el Gobierno Sánchez
La bella feminista italiana que se pasea desnuda entre inmigrantes para probar que «son buena gente»
Esther Palomera se descompone en directo cuando Carlos Cuesta le da con la verdad en los morros
El alcalde de Illescas (PSOE) nombra responsable de Juventud a un concejal coprófago y le echa cuando el escándalo sale a la luz
Isabel Díaz Ayuso sube la apuesta y desliza el nombre que a Pedro Sánchez le causa más escalofríos
¡Sánchez fuera de control! ¡El anuncio de la citación a Begoña le ha destrozado!
Un viejo purgado de Pedro Sánchez certifica la muerte de la legislatura y pone fecha a las elecciones generales
Alfonso Merlos gana en los tribunales a ‘Sálvame’ cuatro años después: 800.000 euros de indemnización
Ridículo espantoso: pillamos a Quequé haciendo una jugada patética para ‘cumplir’ con la sentencia que Cadena SER perdió por insultar a Alfonso Rojo
Alfonso Ussía siembra el pánico en Moncloa esgrimiendo un dato descomunal sobre Begoña Gómez
¿Qué opinan los clientes sobre QDQ?
Hugo Arévalo, el camino del éxito con ThePower Business School
María Reyes Matías Sánchez, especialista en marketing, habla de la publicidad digital y su impacto en la marca
Los comandos israelíes asaltan el hospital Al-Shifa, para acabar con el ‘cuartel’ de Hamas escondido en su subsuelo
Alfonso Ussía siembra el pánico en Moncloa esgrimiendo un dato descomunal sobre Begoña Gómez
La colosal respuesta de Ángel Gaitán a Antonio Maestre: “Eres un…”
Figaredo (VOX) destroza a Adriana Lastra con un zasca doloroso y la socialista le amenaza con los tribunales
Zigor Maritxalar explica la importancia de la formación continua en el entorno laboral actual
¿Tiene tres minutos? No se pierda el demoledor alegato de Frank Cuesta contra Jenni Hermoso y la mafia feminista
Arde laSexta con la salvajada de Tania Sánchez sobre VOX y la impecable bronca de Antonio Naranjo
PERIODISTA DIGITAL, SL CIF B82785809
Avenida de Asturias, 49, bajo
28029 Madrid (España)
Tlf. (+34) 91 173 11 26
[email protected]